Archive for Wrzesień, 2016
Raport zwrotów
W związku z decyzją Głównego Inspektora Farmaceutycznego Nr 29/WC/2016 z dnia 6 września 2016 r oraz nr 30/WC/2016 z dnia 6 września 2016 r. Mazowiecki Wojewódzki Inspektor Farmaceutyczny zwraca się do kierowników aptek ogólnodostępnych, szpitalnych, działów farmacji i punktów aptecznych o przesłanie kopii Raportu o podjętych działaniach zabezpieczających w sprawie wycofania z obrotu produktu leczniczego Atram w dawkach 6,25 mg, 12,5 mg, Simvacard 10 mg, Endiex 200 mg, Zoxon 2 mg, Chlorprothixen Zentiva 50 mg (załącznik nr 3 do rozporządzenia MZ z dnia 12.03.2008 r. DZ. U. 2008 r. Nr 57 poz. 347) na adres wycofanieleku@wif.waw.pl.
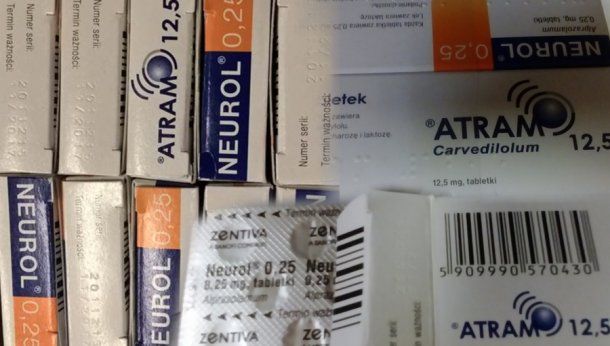
Pomieszanie leków – Atram. Informacja dla pacjenta
W związku z pomieszaniem na linii produkcyjnej w Republice Czeskiej blistrów produktów leczniczych Neurolu (lek psychotropowy), które zostały umieszczone w opakowaniach Atramu (lek kardiologiczny) istnieje niebezpieczeństwo zażycia leku psychotropowego przez pacjentów kardiologicznych. W związku z powyższym zwracam się z prośbą o zwrot leku Atram z podanych niżej serii do apteki w której dokonali Państwo zakupu. Kwestia rekompensaty pozostaje w gestii producenta.
ATRAM 12,5 (Carvedilolum), 12,5 mg, tabletki, nr serii: 2561215, data ważności: 11.2017
ATRAM 12,5 (Carvedilolum), 12,5 mg, tabletki, nr serii: 2510216, data ważności: 01.2018
ATRAM 6,25 (Carvedilolum), 6,25 mg, tabletki, nr serii: 2010216, data ważności: 01.2018
podmiot odpowiedzialny: Zentiva k.s., Republika Czeska
przedstawiciel podmiotu odpowiedzialnego: Sanofi-Aventis sp. z o.o., ul. Bonifraterska 17, 00-203 Warszawa
INFORMACJA DLA APTEK W SPRAWIE WYCOFANIA PRODUKTU LECZNICZEGO
W związku z decyzjami Głównego Inspektora Farmaceutycznego nr 29/WC/2016 z dnia 6 września 2016r. oraz nr 30/WC/2016 z dnia 6 września 2016 r. dotyczącą wycofania z obrotu produktów leczniczych oraz informacjami skierowanymi do pacjentów, przekazywanymi za pomocą środków masowego przekazu, Mazowiecki Wojewódzki Inspektor Farmaceutyczny przypomina, iż zgodnie z Rozporządzeniem Ministra Zdrowia z dnia 12 marca 2008 roku w sprawie określenia szczegółowych zasad i trybu wstrzymywania i wycofywania z obrotu produktów leczniczych i wyrobów medycznych (Dz. U z 2008r., Nr 57 poz. 347):
Kierownik apteki, punktu aptecznego lub placówki obrotu pozaaptecznego po otrzymaniu decyzji
o wstrzymaniu lub wycofaniu z obrotu produktu leczniczego albo decyzji lub powiadomienia o wstrzymaniu wprowadzania do obrotu i do używania, wycofaniu z obrotu albo wycofaniu z obrotu i z używania wyrobu medycznego, na podstawie odrębnych przepisów,
jest obowiązany do:
1. niezwłocznego przekazania decyzji o wstrzymaniu lub wycofaniu z obrotu produktu leczniczego albo decyzji lub powiadomienia o wstrzymaniu wprowadzania do obrotu i do używania, wycofaniu z obrotu albo wycofaniu z obrotu i z używania wyrobu medycznego, w szczególności za pomocą telefaksu lub poczty elektronicznej wszystkim bezpośrednim odbiorcom, bądź informacji o treści wydanej decyzji za pomocą telefonu bezpośrednim odbiorcom, którzy nie posiadają telefaksu lub poczty elektronicznej, z wyłączeniem odbiorców indywidualnych — pacjentów;
2. niezwłocznego zabezpieczenia posiadanego zapasu produktu leczniczego lub wyrobu medycznego przed dalszym wprowadzaniem do obrotu;
3. przekazania do hurtowni farmaceutycznej, w której został nabyty produkt leczniczy lub wyrób medyczny, raportu o podjętych działaniach zabezpieczających;
4. przyjęcia od bezpośrednich odbiorców zwrotów produktów leczniczych — w przypadku procedury wycofania z obrotu;
5. zwrotu zgromadzonego zapasu produktu leczniczego do hurtowni farmaceutycznej — w przypadku procedury wycofania z obrotu nie później niż w ciągu 60 dni od dnia uzyskania przez aptekę decyzji o wycofaniu produktu leczniczego z obrotu.
Komunikat do aptek w sprawie wycofania trzech serii produktu leczniczego Atram.